爵士焦点男士修复膏
weige4812

中枢神经系统(Central Nervous System, CNS)疾病如阿尔茨海默病(Alzheimers Disease, AD)、帕金森病(Parkinsons Disease , PD)、脑肿瘤、亨廷顿舞蹈病(Huntingtons Chorea , HD)、脑卒中(Stroke) 和多发性硬化症(Multiple Sclerosis, MS)等,是全球致残的主要原因和致死的第二大原因,据估计,中枢神经系统疾病的患病率持续上升,到2030年全球将有超过1.03亿人受到影响。
尽管如此,近几十年来,中枢神经系统疾病治疗几乎没有取得进展。目前为止,小分子药物仍然是临床一线用药,但其只能延迟疾病进展不能治愈疾病。近年来,免疫疗法如细胞因子、单克隆抗体和特异性抗原的疫苗接种可能会有助于疾病的治疗,但仍处于研发初始阶段。
随着基因组工程技术的爆炸式发展,基因治疗预示着中枢神经系统疾病治疗新时代的来临。与经典的小分子治疗相比,基因治疗在药物开发中提供了前所未有的杠杆作用,包括可调节传统认为小分子无法成药的蛋白质基因的编码,提高靶点特异性和可逆效应等。
这些新的手段包括质粒DNA、小干扰 RNA (siRNA)、反义寡核苷酸(AONs) 、miRNA、mRNA和CRISPR/Cas介导的基因编辑,然而递送这些基因到大脑仍具有挑战性:1)外周血液循环中基因治疗制剂的快速清除;2)大脑细胞内化不足;3)有限的特异性和脱靶效应;4)无法穿过血脑屏障(BBB)。并且,由于其预先存在的免疫毒性、促肿瘤发生和插入诱变风险等安全问题,许多基于病毒基因治疗的临床转化受到限制。
因此,开发纳米载体作为非病毒药物载体向CNS传递是克服这些困难的重要策略。目前研究的纳米颗粒有无机纳米粒子 (NPs)(例如金纳米粒子和氧化铁纳米粒子)、基于聚合物的纳米粒子、外泌体和脂质体纳米粒子等。与病毒载体相比,这些基于纳米药物的基因传递系统具有多种优势,包括靶向特异性增加、血液循环时间延长、负载能力高、药物释放可控和免疫原性低,更重要的是,在纳米载体上安装大脑特异性配体能够将药物运送到大脑特定病变部位。然而,临床应用仍存在一些障碍:1)NPs 的急性和长期神经毒性仍有待在更广泛的纳米毒性范式中探索;2)NPs的分布和药代动力学与疾病病理生理学之间的关系研究很少;3)扩大 NPs 生产和临床转化的能力和成本效益仍然未知。
近日,莫纳什大学Nicolas H. Voelcker等系统介绍了中枢神经系统疾病的基因治疗及纳米药物的最新进展,相关综述以题为“Delivering the Promise of Gene Therapy with Nanomedicines in Treating Central Nervous System Diseases”于2022年7月18日在线发表于《Advanced Science》上,引起了广泛的关注。
在过去的几十年,关于基因治疗中枢神经系统疾病的研究持续增加(图1A、B),目前临床上还没有批准用于治疗中枢神经系统疾病的基因疗法(图 1C )。为了促进该领域的发展,本综述旨在讨论基于基因治疗的纳米药物治疗中枢神经系统疾病的最新进展,概述它们在临床应用中的特点、优势、潜在的机遇和挑战。
图1 神经系统疾病基因治疗的发展趋势。A) 神经系统疾病基因治疗临床试验;B)神经系统疾病基因治疗发表论文数;C)神经系统疾病基因治疗临床试验现状汇总中枢神经系统疾病的相关治病基因及其治疗潜力如表1。接下来我们进一步总结使用纳米药物将基因调节剂输送到患病脑组织的方法,以及它们穿过 BBB 的潜力。本文试图使用对纳米医学方法的系统评价对跨学科发展提供见解,以实现治疗中枢神经系统疾病的基因疗法。
表1 治疗中枢神经系统疾病的潜在致病基因及临床试验
2.1 阿尔茨海默病(AD)A是最大的中枢神经系统疾病,目前对AD神经病理学的大部分理解是基于大脑中淀粉样蛋白β(Aβ)的积累和有助于形成神经原纤维缠结 (NFT) 的异常磷酸化tau蛋白。迄今为止,全基因组关联研究(GWAS)和实验研究的组合已经确定了许多与早发性AD (EOAD)和晚发性AD (LOAD)相关的易感基因。包括脂质代谢(例如APOE、APOC1、APOM、APOA5、ABCA1)、免疫反应(例如CLU、CR1、RELB)、tau途径(例如B1N1、CD2AP 、SCNA、APOM、APOA5、FERMT2、CASS4、PTK2B)和淀粉样前体蛋白(APP)代谢(例如,FERMT2、PICALM)。某些基因中的一些常见或罕见的功能变异也显示出与AD的关联,例如APOE、CR1、TREM2、CLU、CD33、ECHDC3和ACE。在已发现的遗传风险因素中,编码载脂蛋白E的APOE是最有效的易感基因,它对LOAD的遗传变异有30%以上的贡献。除了APOE,其他三个基因的突变,包括分别编码APP、PSEN1和PSEN2编码早老素1和 2的APP,也被认为对AD中的神经退行性有重要影响。编码免疫受体的基因也已被确定为AD的遗传风险因素,包括编码髓细胞2上表达的触发受体的基因TREM2。其他一些遗传因素,如CD33、CD36和toll样受体4 (TLR4),也被发现可降低Aβ-诱导细胞因子产生和调节神经炎症。这些是开发用于 AD 治疗的基因疗法的潜在目标。除了上述AD的遗传风险因素外,编码神经营养因子的基因也被认为是AD基因治疗的潜在靶点。尽管对于大多数AD基因座的功能变体和生物学途径仍有待进一步研究,但已进行了各种基因治疗的尝试。
2.2 帕金森病(PD)PD是第二常见的中枢神经系统疾病,其病理特征是黑质中多巴胺能神经元的丧失和中脑中出现称为路易体的蛋白质聚集体。迄今为止,多个GWAS已经确定了90多种导致早发性和迟发性PD疾病风险和进展的遗传变异,包括罕见和常见的遗传变异,例如SNCA、GBA、LRRK2、VPS13C和PRKN 。有几种途径与这些基因相关,包括溶酶体和内吞途径(例如,GBA、LRRK2、SNCA、VPS35)和线粒体损伤修复/消除途径(例如,PARK7(或 DJ-1)、PRKN、粉红色1 )。然而,许多基因的相关性仍然存在争议,它们的生物学功能也仍然知之甚少。除了与疾病有关的基因的编码变体外,非编码变体也通常会增加 PD 的风险。
2.3 脑肿瘤脑肿瘤是一种毁灭性疾病,占所有癌症的2%在过去的几十年里,进行了多项研究来研究常见和罕见脑肿瘤中肿瘤发生的遗传基础。胶质瘤是成人最常见的原发性脑肿瘤,一般可分为胶质母细胞瘤(GBM)和低级别非GBM肿瘤,如II级星形细胞瘤、II级少突胶质细胞瘤。值得注意的是,GBM和非GBM胶质瘤的遗传易感性相对不同。迄今为止,GWAS 和全转录关联研究 (TWAS) 已经确定了许多与GBM(例如,EGFR、TP53、FGFR、PTEN、CDKN2A、TERT、TERC)和非GBM神经胶质瘤(例如,VTI1A、MDM4、AKT3,、IDH1、TREH、TERT、TMEM25、PHLDB1 )。这种区别在一定程度上反映了疾病的不同病因,也暗示了不同的可药用基因靶点。GBM已发现三种途径与频繁的遗传改变密切相关,包括:1)受体酪氨酸激酶信号传导(例如,PTEN/NF1/PIK3CA、EGFR/PDGFRA);2) 肿瘤蛋白 53 (TP53) 信号转导(例如,CDKN2A、TP53、MDM1/MDM4);3) 视网膜母细胞瘤 (RB) 信号传导(例如,CDKN2A/CDKN2C、RB、CD4/CD6)。许多 miRNA 已被证明与 GBM 中的细胞增殖、分化、凋亡、迁移和血管生成有关。到目前为止,许多 miRNA 的改变已被确定为潜在的 GBM 生物标志物,包括 miR-21、miR-221/222、miR-124、miR-128、miR-7、miR-137、miR-181、miR-218、 miR-148a 和 miR-10b。它们参与调节GBM关键驱动基因的表达,例如EGFR(例如,miR-7)、MGMT(例如,miR-181d、miR-198)和BCL2(例如,miR-7)。治疗方法还针对调节参与表观遗传改变的其他基因,包括DNA甲基化、组蛋白修饰和染色质结构畸变。
2.4 亨廷顿舞蹈病(HD)HD 是一种遗传性进行性中枢神经系统疾病,其特征是运动障碍、认知能力下降以及行为和精神症状。与其他中枢神经系统疾病不同,HD是由编码亨廷顿蛋白的HTT基因中的单基因突变体(CAG 三核苷酸重复扩增)引起的,已发现该突变决定了 HD 发病的时间。大量研究表明,HTT 突变体、CAG RNA 毒性、HTT 功能丧失、polyQ 蛋白错误折叠和聚集会影响多种细胞生物学过程,例如线粒体功能障碍、氧化应激、转录失调,从而导致HD 发病。但到目前为止,还没有治愈性药物。除了HTT基因之外,最近还发现了几种通过不同机制编码与 HD 相关的蛋白质的遗传修饰物,例如 Nme1、NF(提供神经营养支持)、CYP46A1(影响脑胆固醇代谢)和 TLR4/TREM2(影响炎症)。通过靶向这些基因治疗HD,使得HD动物模型中HTT聚集减少、运动性能改善,这可能是 HD 药物开发的潜在治疗靶点。
2.5 脑卒中脑卒中是全球第二大致死、致残原因,脑卒中有两种亚型,包括主要由脑梗塞引起的缺血性脑卒中(约占 80%)和由渗漏性出血引起的出血性脑卒中(占 20%)。代谢风险(例如,高血压、体重指数、血糖、总胆固醇)和行为因素(例如,吸烟、不良饮食、低体力活动)是脑卒中的主要风险因素。与其他类型的CNS疾病相比,脑卒中的发病机制中遗传因素占比较少。多个 GWAS 发现了大约 32 个与脑卒中和脑卒中亚型(例如TSPAN2、PMF1-SEMA4A、CASZI、WNT2B)相关的风险位点和 18 个相关通路,包括各种心脏通路、肌肉细胞命运承诺和一氧化氮代谢过程。尽管有这些发现,到目前为止还没有报道针对这些风险位点的基因疗法。许多非编码 RNA (ncRNA),例如 miRNA 和circ RNA,也被报道参与了脑卒中的生物学过程并归因于脑卒中的发病机制,例如 miR-17-92、miR-195、miR- 152、mi-124 miR-130、miR-381-3p、miR-652 和circSCMH1。这些 ncRNA 在未来可能被用作脑卒中的预后、诊断和治疗生物标志物。鉴于脑卒中的治疗窗口很窄(几小时),特别是在急性缺血性脑卒中中,基因治疗的应用在某些情况下可能不适合。
基因疗法治疗CNS疾病已在临床、临床前研究中得到广泛研究。每种基因治疗方法的机制在很大程度上决定了纳米药物设计的原则。
图2 涉及主要CNS疾病基因疗法的示意图。开发了各种基因疗法,包括 miRNA、siRNA、AONs、mRNA、质粒DNA和CRISPR-Cas,靶向和调节CNS致病基因的表达3.1 干扰RNARNA 干扰 (RNAi),也称为RNA沉默或转录后基因沉默,于1998年由Fire et al.首次使用,是治疗脑疾病的潜在疗法之一。外源核酸可以通过实验工程改造到细胞中,从而干扰致病基因的表达,进一步调节特定蛋白质的产生。小非编码RNA (ncRNA)通常由20-30个核苷酸组成,并与Argonaute家族蛋白结合,将小ncRNA引导至其所调控的基因目标处。根据生物发生、靶点调控方式和生物学途径调控的不同,小ncRNA主要分为三种类型,包括microRNA(miRNA)、小干扰RNA(siRNA)和PIWI-interaction RNA(piRNA)。小ncRNA通常具有清除快速、先天免疫反应诱导和酶易降解等特点。
与其他组织相比,大脑具有更明显的miRNA表达,因此使miRNA成为开发CNS疾病治疗剂的潜在靶点。例如,发现miR-31在AD患者中表达水平降低。Barros-Viegas等人用携带miR-31的慢病毒颅内注射到AD三重转基因 (3xTg-AD) 小鼠的海马中,导致BACE1 mRNA水平和APP产生同时降低,与此同时,这些老鼠的认知能力得到了显着改善。也发现一些miRNA的过表达会导致神经功能障碍。例如,两种有效的onco-miRNA,即miR-21和miR-10b,在许多GBM患者中过表达,导致存活率低、增殖快、转移和对治疗TMZ产生抗性。Malhotra等人通过cRGD标记的PEG-PLGA NP将两种反义microRNA(antagomiRs)即antagomiR-21和antagomiR-10b通过循环递送到异种移植GBM小鼠模型中,发现这些antagomiRs增强了GBM细胞对治疗的反应,移植后的GBM小鼠中治疗只需较低剂量的TMZ。
RNA敲低也可以通过小干扰 RNA (siRNA) 实现,siRNA(≈21-23 个核苷酸,带有 2 个核苷酸3突出端)是由Dicer介导的长双链RNA结构自然产生的ncRNA。改进的siRNA经过合理设计已被广泛用于开发CNS疾病疗法。例如,Wang等人给AD小鼠模型静脉注射含有靶向BACE-1的siRNA的纳米复合物,可降低BACE-1表达,改善AD小鼠的认知功能。Spencer等人讲载有靶向α-sy蛋白siRNA的纳米复合物静脉内注射到PD小鼠模型中,使得模型小鼠大脑中α-syn显着减少。siRNA还被设计用于靶向GBM癌基因。例如,李等人设计了针对人透明质酸介导的运动受体(HMMR)的反义RNA1(AS1)或HMMR致癌基因的siRNA,体外实验发现,经过处理的癌细胞HMMR表达显着降低,GBM肿瘤细胞细胞生长、迁移和侵袭能力降低。此外,siRNA在针对HD和脑卒中治疗的致病基因中也有研究。例如,Save 等人经鼻内给药含有靶向致病基因的siRNA的壳聚糖纳米粒子后,超过50%的HD小鼠的大脑中其mRNA减少。另一项研究通过全身注射载有靶向siRNA 的curdlan NPs在脑卒中小鼠中敲除表达核因子 (NF) -κB p65的基因,增加了神经元密度并减轻了大脑中的核固缩和神经元坏死。总而言之,siRNA已被用于特异性靶向CNS疾病中的多种生物标志物,但仍有许多挑战需要解决。
PIWI-interaction RNA(piRNA,26-32 个核苷酸)是衍生自单链前体RNA的非编码小 RNA。piRNA的产生通常由Zucchini一种核酸内切酶蛋白)和其他未知的修剪酶介导,而不是由RNase III介导。迄今为止,尚未报道针对中枢神经系统疾病的piRNA基因疗法,随着研究进一步深入,piRNA可能成为未来的潜在治疗手段。
3.2 反义寡核苷酸反义寡核苷酸 (AONs) 是合成的单链核酸(16-22 个核苷酸),可以抑制特定RNA(如 siRNA、mRNA、pre-mRNA等)的表达水平,并调节蛋白质翻译。AON 不是在细胞中自然表达,是通过骨架修饰(如N-乙酰半乳糖胺)和添加细胞穿透肽 (CPPs),实现良好的细胞穿透能力,进入细胞后通过多种途径调节基因和蛋白质的表达。AONs一旦与同源基因相互作用,它们就可以通过与RNase H1相互作用直接降解目标转录物。AONs不仅可以像siRNA那样只靶向成熟的mRNA,还可以靶向细胞核中pre-mRNA 和/或lncRNA的外显子和内含子,以及细胞质中的成熟mRNA,实现基因沉默效应。AONs也可以设计成在不触发转录物降解的情况下阻断靶基因的表达,通常被称为空间阻断AONs。到目前为止,这种AONs已被FDA批准用于多种疾病,包括用于治疗Duchenne肌营养不良症的 Eteplirsen (2016) 和Golodirsen (2019),以及用于治疗脊髓性肌萎缩症的Nusinersen (2016)。
已经开发出通过各种机制起作用的AON来治疗不同的中枢神经系统疾病。DeVos 等人研发了一种靶向和降解tau mRNA的AON,可以选择性地减少小鼠AD模型中的tau mRNA 和tau蛋白,延长模型小鼠寿命。Ward等人开发了一种AON来阻断HeLa细胞中的外显子-内含子连接,将STAT3基因的翻译减少了60%(STAT3基因是AD和PD中的疾病驱动基因)。Mogilevsky等人的研究表明,除了降解和阻断基因表达之外,AON还被设计用于外显子跳跃。因此,他们专门设计了一种AON,在MnK2基因的可变剪接中诱导强烈的转换,促进MnK2a的表达,同时抑制MnK2b的表达,此举提高了GBM细胞对化疗的敏感性,抑制了GBM模型小鼠的肿瘤发展。上述研究大多数直接将AON注射到测试动物中,需要大剂量的AON才能达到治疗效果。因此具有高风险的副作用和高成本。
3.3 质粒DNA质粒DNA是环状dsDNA,可以独立于宿主的染色体DNA进行复制。天然存在于细菌中,并提供诸如抗生素抗性和降解等益处。研究表明,当质粒大小达到20 kbp时,其转染效率不受影响。与病毒载体相比,通过质粒DNA在宿主细胞中持续表达感兴趣的遗传物质,引起插入诱变和免疫原性等安全并发症的可能性较低。递送表达与CNS疾病相关蛋白质的质粒DNA均有报道,如上NF、肿瘤生长抑制剂4、肿瘤坏死因子相关凋亡诱导配体和血管生成因子等。Aly等人将编码肿瘤生长抑制剂4的质粒鼻内注射到PD大鼠模型中,行为测试和TH免疫染色显示其运动功能和多巴胺能纤维密度得到改善,体内证明了该质粒对PD具有治疗效果。
3.4 mRNA信使RNA (mRNA)是一种单链编码 RNA,由用于翻译蛋白质的遗传信息组成。mRNA 的平均长度约为3 kbps,不超过 15 kbps。与质粒 DNA 相比,mRNA向细胞的传递障碍小, 1) mRNA不需要传递到细胞核;2) mRNA 比质粒 DNA 小。与质粒DNA类似,mRNA将在胞质中被翻译成治疗性蛋白质。因此,合成mRNA是一种非常有用的外源性替代治疗方法,可逆地改变CNS疾病中的蛋白质表达。与基因编辑相比,mRNA表达的致癌和诱变风险更低。然而,mRNA作为治疗工具的临床应用受到其转染后的不稳定性和免疫原性的限制。在新冠大流行期间,基于mRNA的疫苗已成为全球使用的主要疫苗之一。BioNTech/Pfizer和Moderna使用基于脂质的NPs (LNPs) 作为载体将mRNA输送到细胞质中。
与 AONs或miRNA相比,mRNA和质粒DNA更难以传递到CNS。为了穿过BBB或血脑肿瘤屏障 (BBTB) 并进入神经元以实现其理想的治疗结果,mRNA和质粒DNA 需要克服更大的尺寸和电荷障碍。目前正在研究基于mRNA的CNS疾病治疗的多种策略。
3.5 长链非编码RNA (lncRNA)长非编码 RNA (lncRNA),是含有200多个核苷酸的转录本,它们不会翻译成蛋白质。但研究发现许多lncRNA在许多细胞环境和生物过程中发挥着不同的功能,包括转录调控、mRNA稳定性调节和翻译后修饰。一些lncRNA已被报道可编码小蛋白质。一些 lncRNA 被发现在 CNS 发育、可塑性和脑疾病进展中发挥关键作用。这为设计用于CNS疾病治疗的治疗策略提供了启示,但该方向在很大程度上仍有待进一步了解。
3.6 CRISPR-Cas系统成簇的规则间隔短回文重复序列 (CRISPR) 和 CRISPR 相关蛋白 (Cas) 系统是众所周知的基因组工程技术,可实现精确的基因插入、删除、表达促进或抑制。2020 年,诺贝尔奖授予Emmanuelle Charpentier和Jennifer A. Doudna,以表彰他们对CRISPR的杰出发现,极大地推动了这一领域的发展。
应用CRISPR-Cas9治疗中枢神经系统疾病主要有三种方法。其中,最常用的方法是通过创建DSB和indel来破坏疾病相关基因的表达,这是在创建DSB后随机插入感兴趣的基因。当致病基因或遗传风险因素仍在探索中,或者致病基因太短而无法切割时,这种方法可用于治疗中枢神经系统疾病。纠正目的基因是CRISPR-Cas在中枢神经系统疾病领域应用的第二种方法。第三种方法是通过禁用Cas9的切割功能并向Cas9添加额外的组件可逆地调节基因表达。被禁用的Cas9称为死Cas9核酸酶 (dCas9),如果dCas9与其他域融合,dCas9失去切割能力,但仍然可以识别目标基因并执行其他功能。CRISPR-Cas9系统通过停止、纠正或可逆地改变目的基因的表达,精确探索或操纵CNS疾病基因,为疾病治疗提供了新的可能性。尽管取得了许多有希望的结果,但CRISPR-Cas9方法仍未进入CNS疾病的临床试验。体内通常通过病毒载体(例如,AAV)递送CRISPR-Cas9,但存在免疫原性高、转基因容量有限(约 4.8 kb)等问题,并且一旦细胞开始表达CRISPR-Cas9 RNP就不可控因此,需要开发CRISPR-Cas9复合物的非病毒递送方法,尤其是纳米载体,以减少给药途径的侵袭性等。纳米载体如金纳米粒子、磁性纳米粒子是一种很有前途的递送方法,可将 CRISPR-Cas9系统以较小的侵入性和靶向性递送至CNS疾病部位,并有望克服将CRISPR-Cas9引入临床的一些障碍。
3.7 backbone修饰裸露的核酸通常存在体内降解和快速清除等问题,因此已经开发了各种骨架修饰策略来修饰核酸(例如,siRNA、AON),例如硫代磷酸酯(PS)、2-O-甲基( 2-O-Me)、2-O-甲氧基乙基 (2-MOE)、2氟 (2-F)、锁核酸 (LNA) 和吗啉代 (PMO)。这里的重点是最常用的骨架修饰,以增强遗传调节剂的稳定性、细胞摄取和结合亲和力(图3)。PS 修饰是第一代修饰(磷酸基团中的非桥接氧原子),通常被引入以赋予核酸抗核酸酶并延长其循环半衰期。第二代骨架修饰包括2位烷基修饰,如2-O-Me、2-MOE、2-F。其中,对siRN(例如,2O-Me 和 2-F)的2核糖修饰显示增加了siRNA在RISC上的负载,导致基因沉默效力增加。第三代修饰,主要修饰呋喃糖环,如PMO和LNA。(图3)
图3 主干修改。寡核苷酸有许多不同的骨架修饰,可以从第一代到第三代进行分类BBB 是一个完整的代谢和物理屏障,可调节CNS的稳态。它是血液和神经元之间的离子、营养物质和细胞等分子最重要的界面之一。BBB主要由脑内皮细胞以及大量的周细胞、星形胶质细胞和通过紧密连接相互连接的神经细胞形成。BBB的紧密连接保护大脑免受有害物质和有毒物质的伤害,并控制对正常神经元功能至关重要的CNS微环境。在AD、PD、HD和脑卒中在内的许多CNS疾病中,BBB的完整性通常会受到一定程度的破坏。在脑癌中,被破坏的BBB也被称为血脑肿瘤屏障 (BBTB)。尽管在这些疾病条件下受到损害,但BBB的紧密连接仍然限制了外来物质进入脑实质,包括携带核酸进入大脑的纳米药物,从而限制了它们的基因转染效率。
5.1 无机纳米颗粒(NPs)无机纳米粒子具有特殊的物理、化学、光学和电学特性,与有机纳米颗粒相比,无机纳米颗粒具有坚固的结构骨架,可为内部货物提供强大的物理支撑。使用生物相容性材料(例如靶向配体、生物分子、稳定剂)修饰无机纳米粒子的表面很常见,以增强其胶体稳定性、血脑屏障渗透性、传递遗传因子的能力以及特异性识别大脑内病变部位等。迄今为止,已开发了多种无机纳米粒子,包括金纳米粒子、磁性纳米粒子、量子点、二氧化硅/硅纳米粒子和铜纳米粒子。
5.1.1 金纳米颗粒(NPs)金纳米粒子 (AuNPs) 是生物医学应用中最常见的无机纳米药物之一,因其有易于调节的尺寸、形状、对生物分子的高亲和力以及易于合成/修饰等优点。在各种形状中,金纳米球和纳米棒是CNS疾病研究中最常用于基因传递的。此外,纳米星、纳米壳、纳米簇和纳米花也被报道用于非中枢神经系统疾病研究中的基因传递。(图4)
图4 用于中枢神经系统疾病基因治疗的无机纳米粒子。A-D) 用于治疗GBM的miRNA递送的金-氧化铁 NPs (GION)5.1.2 磁纳米颗粒(NPs)磁性纳米粒子(MNPs)作为中枢神经系统疾病的基因传递系统已被广泛研究,因为它们具有独特的超顺磁性,允许在外部磁场下进行引导和靶向基因传递。通常,MNP 由磁芯(例如,铁、镍、钴和它们的氧化物)和通过各种表面化学(例如,NGF、PEG、TWEAK)的非磁性涂层组成,这使得核酸递送和组织/细胞渗透成为可能。其中,氧化铁 NPs(Fe3O4或其氧化且更稳定的形式 Fe2O3) 由于其生物相容性和生物降解性,是最常用于生物医学应用的探索形式。在外部磁场的作用下,可以引导携带核酸的MNP粘附在细胞膜上,从而增加它们在靶细胞中的积累,可以通过移除磁场资源终止粘附。尽管MNP诱导的细胞积累不会影响遗传物质的核靶向和内化,但细胞质中基因积累可能会促进核转位和浸润。这一独特功能在CNS疾病的各种治疗应用中引起了广泛关注,包括针对PD、GBM、AD和脑卒中的靶向基因递送。此外,MNP作为一种理想的造影剂,可以在磁共振成像系统 (MRI) 下直接可视化和跟踪,引导基因传递。然而,MNPs 对于基因递送在CNS疾病患者的实际应用仍处于早期阶段,其中MNPs的安全问题仍然是阻碍MNPs进一步应用的主要障碍。MNPs的另一个障碍是大规模合成过程中均匀性差、批量变化大,这对MNPs的物理化学性质产生负面影响,从而影响其在实际应用中的基因传递效率。(图5)
图5 磁性NP联合基因传递和细胞治疗治疗脑卒中5.1.3 量子点量子点通常是胶体半导体纳米材料,由于其独特的光学和电子特性,已成为最近基因传递的焦点。历史上,许多荧光 NP,例如二氧化硅、锗、金、银、碳点和石墨烯点,都被称为 QD。量子点具有可调节的大小和通用的表面化学性质,可以与核酸和其他生物分子(例如蛋白质和抗体)结合。它们已被用于传递和检测CNS疾病的基因调节剂。量子点被认为是优于许多荧光团的优质材料,因为它们具有理想的窄光谱、明亮的发光、高量子产率、宽光吸收以及高光稳定性和化学稳定性。这些独特的光学特性使我们能够可视化NP 在细胞或动物中的内化。(图6)
图6 基于 QD 的CNS疾病基因治疗5.1.4 硅基纳米颗粒(NPs)硅基NPs (SiNPs) 正在成为另一种有吸引力的材料。SiNPs有两种主要类型,元素硅NPs 和二氧化硅 (SiO2 ) NPs,它们通过不同的方法合成。二氧化硅和硅纳米粒子具有许多独特的特性,包括可调节的粒径、理想的生物相容性、体内生物降解性和多功能表面改性。其中介孔二氧化硅NP(MSN)和多孔硅NP(pSiNP)是用于CNS基因递送常见形式。
5.1.5 其他无机纳米颗粒(NPs)除了上述无机纳米颗粒外,其他无机纳米颗粒如铜纳米颗粒也已用于中枢神经系统基因传递。到目前为止,只有少数无机 NPs 进入了临床试验。几个关键挑战有待进一步解决,包括它们的潜在毒性(尤其是神经毒性)、脱靶、团聚和难以统一批量生产等问题。
5.2 聚合物纳米颗粒(NPs)基于聚合物的纳米颗粒(PNP)已被用于CNS疾病药物开发最广泛研究的基因传递系统之一。PNP具有许多优点,包括具有理想的生物相容性、可控的生物降解性和持续递送。三种类型的PNP通常用于脑部基因制剂的传递,包括合成PNP、天然PNP和混合NP。几种合成聚合物通常用于制造PNP,如聚 (乳酸-乙醇酸共聚物) (PLGA)、聚乙烯亚胺 (PEI)、聚乙二醇 (PEG)、聚-L-赖氨酸 (PLL)、聚 (氰基丙烯酸烷基酯) (PACA)、聚乳酸 (PLA)、聚己内酯 (PCL) 和树枝状聚合物。其他一些天然材料也被广泛用于制造PNP,例如壳聚糖、葡聚糖和海藻酸盐。(图7)
 图7 用于AD治疗基因传递的工程化聚合物NP
图7 用于AD治疗基因传递的工程化聚合物NP根据电荷,PNP可分为阳离子、阴离子和两性离子聚合物,它们在同一聚合物链中带有相等的阳离子和阴离子基团。带正电荷的聚合物通常是含胺聚合物通过静电相互作用封装或吸附带负电荷的核酸,使它们成为CNS疾病基因传递的有用工具。值得注意的是,某些聚合物的电荷可能会在某些刺激下发生改变,例如 pH、光、酶、温度和氧化还原。这种电荷转换,通常由不稳定的化学键的断裂或可电离基团的电离/去离子触发,提供了持续传递和触发释放封装遗传货物的优势。这种特征可以促进用于中枢神经系统疾病的核酸递送。
除了直接用于形成纳米粒子的核心外,聚合物还广泛用作大脑基因传递的表面修饰材料。其中,各种分子量、表面密度和官能团的 PEG 是使用最广泛的聚合物之一。表面的 PEG 不仅为 NPs 提供了不结垢的表面,不仅延长了它们的血液循环,导致更深的脑实质扩散,而且降低了免疫原性、表面聚集、调理作用和吞噬作用。(图8)
 图8 用于将基因递送至大脑的聚乙二醇化NP
图8 用于将基因递送至大脑的聚乙二醇化NP树枝状大分子也是为CNS疾病基因传递而研究的合成聚合物,通常具有高度分支的3D紧凑结构,由中央核心和日冕组成。到目前为止,已经开发了不同代的树枝状大分子,其中聚(酰胺胺)(PAMAM)树枝状大分子是最常被探索的。PAMAM内部有丰富的官能团,尤其是伯胺和叔胺基团,它们被质子化并为带负电荷的核酸提供带正电荷的表面。已经进行了许多尝试来探索树枝状大分子在 CNS 基因递送中的应用。与其他聚合物材料一样,树枝状大分子可用于直接形成纳米载体的核心以容纳遗传货物。(图9)
 图9 使用树枝状大分子将基因传递到大脑进行缺血性脑卒中治疗
图9 使用树枝状大分子将基因传递到大脑进行缺血性脑卒中治疗两亲嵌段共聚物 (BCPs) 具有窄分布的分子量和分隔链段,是另一种在CNS疾病基因传递中广泛探索的聚合物材料。它们可以自组装成高度有序的多分子结构,包括胶束和中空囊泡。BCPs通常由疏水核心和亲水的外部电晕组成,其高溶解度和低毒性是基因递送的有效属性。
5.3碳纳米管纳米管 (CNT) 是具有圆柱形形状的纳米管,由 sp2杂化碳原子(也称为石墨烯)的六边形排列组成。根据层数,碳纳米管可分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)。由于与生俱来的疏水特性,碳纳米管通常难以分散在水相中。表面改性不仅可提高它们的溶解性和生物相容性,而且可以提高靶向能力。单壁碳纳米管的尺寸通常为0.4-2纳米,长度可达几微米,而多壁碳纳米管的尺寸范围为2-100纳米,长度可达几十微米。由于体积小、表面积与体积比高以及包含生物活性分子的能力强,CNT在为CNS疾病递送基因治疗方面显示出巨大的潜力。碳纳米管可以有效地渗入细胞并进入细胞核,因此允许细胞和细胞核传递遗传物质。由于 MWCNT 的直径较大,因此认为 MWCNT 在其内壁中能够容纳比 SWCNT 更多数量的治疗材料。遗传材料可以在末端或侧壁共价连接碳纳米管。这种功能化通常通过酸性处理(例如HNO 3)或通过在CNT的sp2碳骨架上进行环加成反应,首先在CNT上产生羧酸基团,可进一步与各种分子(例如肽,蛋白质、抗体和遗传物质)缀合。π-π堆积和范德华相互作用在管状表面或内部区域内非共价捕获分子。值得注意的是,尽管 CNT在基因治疗传递中的应用正在迅速扩大到其他疾病研究,但它们在大脑基因治疗传递中的应用仍处于早期阶段,需要更多的研究来进一步证明它们穿越 BBB的能力,并证明CNT在大脑中产生的毒性小。
5.4 外泌体外泌体是天然的细胞外纳米囊泡(<150 nm),具有由各种细胞类型分泌的亲水双层。已发现许多 CNS 细胞和其他细胞具有释放外泌体的能力,例如 HEK-293、树突状细胞、MSCs 和神经胶质瘤细胞。基于外泌体的基因传递平台提供了许多独特的生物学特性,低免疫原性、高生物相容性和多功能性以及低聚集潜力。与其他合成纳米载体不同,外泌体参与免疫系统和神经系统的各种生理和病理过程。源自某些细胞类型的外泌体,例如脂肪来源的 MSC、骨髓 MSC 和神经胶质瘤细胞,表现出穿过 BBB 和其他生物屏障的天然能力。这些使外泌体成为将基因传递到大脑的有用工具。(图10)
 图10 使用外泌体进行AD的脑基因传递
图10 使用外泌体进行AD的脑基因传递外泌体膜修饰可以提高其靶向效率。尽管天然外泌体具有细胞衍生部分,但通常研究的外泌体主要来源于非神经元细胞,如树突细胞或肾细胞,它们可能缺乏靶向脑细胞的能力。表面工程可以增强他们的大脑定位能力,减少调理作用和隔离,并控制货物释放。一种典型的方法是将外泌体外膜与不同的神经元特异性肽(如 RVG和T7)融合,这可以通过用 pRVG-lamp2b/pT7-Lamp2b 转染外泌体产生的细胞来实现,或通过用靶向肽对外泌体进行后期修饰。(图11)
 图11 在GBM中,CNP用于大规模生产递送mRNA的外泌体
图11 在GBM中,CNP用于大规模生产递送mRNA的外泌体最近细胞治疗和合成生物学技术的突破也促进了基于外泌体的基因递送在脑疾病中的发展。Kojima 等人对HEK-293细胞进行了重编程,转染外泌体生产促进基因(例如STEAP3、SDC4和NadB)、胞质递送辅助基因(Cx43 S368A)、RNA 包装对 (CD63-L7Ae)、编码靶向分子的基因 (RVG)和 mRNA 来产生外泌体。这种设计可将外泌体产量提高50倍以上,并在体外和体内PD模型中取得了理想的临床前结果,包括提高了mRNA 传递效率、降低了神经毒性和神经炎症。这种基于合成外泌体的基因传递策略,提供了一种可靠且可行的方法来控制细胞间通讯,且无需浓缩外泌体。(图12)
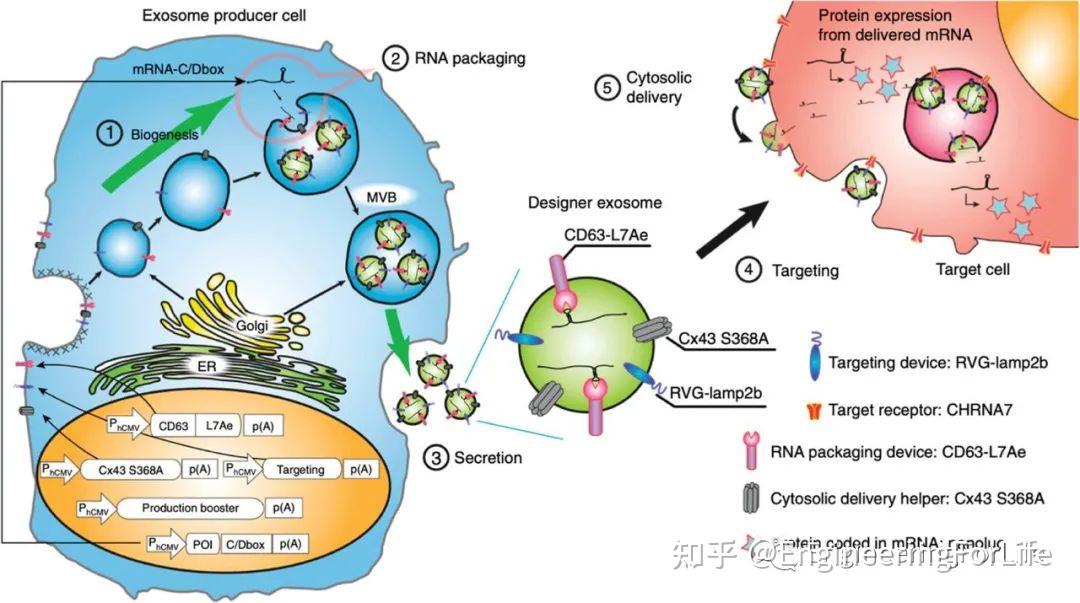 图12 用于递送mRNA的EXOtic装置示意图
图12 用于递送mRNA的EXOtic装置示意图外泌体在脑疾病研究中的研究仍处于起步阶段。外泌体的应用需要克服几个关键挑战:1)目前对外泌体在中枢神经系统和其他组织中参与生物学过程的具体作用机制仍不清楚;2)提高所需外泌体的生产效率和可重复性,以及提高货物封装效率和转染效率。相信随着纳米技术、合成生物学等的进一步创新将推动基于外泌体的基因递送在治疗CNS疾病中的运用。
5.5 脂质纳米颗粒(NPs)基于脂质的NPs (LNPs) 是含有水内核和磷脂双层的囊泡。通常,它们由含有极性头基(亲水)和非极性尾基(疏水)的生物可降解和生物相容性材料制成,例如胆固醇、磷脂和脂肪酸。双层组分使 LNP 能够将疏水性和亲水性生物活性分子(包括核酸)封装到脂质双层或水性核心中。阳离子脂质,例如 1,2-di- O-十八烯基-3-三甲基铵-丙烷 (DOTMA) 脂质、1,2-二油酰基-3-三甲基铵-丙烷 (DOTAP),和两性离子脂质,例如 1,2-二油酰基-sn-甘油-3-磷酸乙醇胺 (DOPE) ,已单独或联合用于脑基因的传递。2020年,LNP被FDA批准用于COVID-19mRNA疫苗的递送,这凸显了它们在基因治疗领域的巨大潜力。(图13)
 图13 使用脂质体进行基因传递用于GBM治疗
图13 使用脂质体进行基因传递用于GBM治疗一些脂质体制剂如 lipofectamine 已经商业化几十年,用于核酸的体外和体内递送。但是 lipofectamine和其他阳离子脂质体的转染功效受到可能产生的细胞毒性、免疫原性的影响。经常使用 lipofectamine 产品作为基准,进行大量研究以开发替代或优化的LNP。(图14)
 图14 使用脂质体进行基因传递用于GBM治疗还可开发可电离的脂质以提高基因传递效率。通常,可电离氨基脂质包含三种主要成分:亲水性胺头、疏水性脂质链和连接两部分的接头。(图15)
图14 使用脂质体进行基因传递用于GBM治疗还可开发可电离的脂质以提高基因传递效率。通常,可电离氨基脂质包含三种主要成分:亲水性胺头、疏水性脂质链和连接两部分的接头。(图15) 图15 向大脑输送核酸的可电离脂质
图15 向大脑输送核酸的可电离脂质综上所述,基于基因治疗的纳米药物进展迅速,导致在CNS疾病中的应用大量增加。其中许多研究成果已经表现出较强的靶向能力,并在临床前研究中取得较好的疗效。尽管面临各种困难,在临床转化和商业化中受到限制,但在CNS疾病治疗方面取得了显著进展。随着生物学、材料科学、化学和药剂学的多学科的发展,必将基因治疗的前景转化为可实践的医学成果。
文章来源:
首次添加免费领取喷剂小样